特集記事:好中球が感染源に移動するための基本原理を解明!
|
九州大学生体防御医学研究所 免疫遺伝学分野
福井宣規教授
私たちは、細菌やウイルス、カビといった多くの外敵にさらされながら生きている。その割には、感染して熱や下痢などの症状が出ることが少ない。生体内では、免疫細胞が常時、病原体の侵入を監視し、図らずも侵入を許してしまった場合には、ただちに攻撃、抗体の産生、抗体による病原体の中和といった一連の免疫システムを稼働させるからだ。その最前線で病原体と戦うものに、好中球とよばれる白血球がある。好中球は、細菌などの感染源に向かって移動し、病原体を食べてしまう(どん食という)が、どのようにして移動するのかは未解明だった。九州大学生体防御医学研究所 免疫遺伝学分野の福井宣規教授は、好中球内で2種類のリン脂質が段階的に産生されることで、一連の反応のスイッチがオンになり、最終的に時間的・空間的な移動を制御していることを明らかにした。
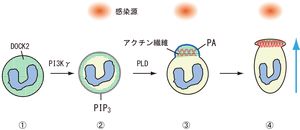
好中球は感染源を感知すると、その方向に向かって「仮足」とよばれる突起を伸ばす。仮足は、細胞骨格をなすアクチン繊維からなり、このアクチン繊維が細胞の一部でのみ網目のような構造を作ること(再構成という)で、仮足を伸張させ、細胞の推進力を生み出す。感染源にたどり着いた好中球は、ただちに病原体をどん食しはじめ、さらに活性酸素を作り出すことで病原体を駆逐・除去する。これまでの研究により、アクチン再構成や活性酸素産生のスイッチを入れるのはRacとよばれるタンパク質で、その際に感染源からの刺激によって作られるリン脂質(PIP3)が協調して機能することが必須であると考えられていた。
では、Racを活性化する分子は何なのか。福井教授らは、タンパク質を活性化させるためにはたらく因子(GEF)のうち、免疫系だけでみられるものを探索した。その過程でDOCK2という因子を同定することに成功し、ノックアウトマウスを作製することで、その機能解析も進めた。「DOCK2は抗体による獲得免疫系では重要な機能を発揮することがわかったが、自然免疫における機能は謎だった。この点を解明しようとしたのが、今回の研究の始まりだ」と福井教授。
福井教授らはまず、DOCK2を欠損したマウスの好中球を詳しく調べてみた。「そのような好中球は、移動(遊走という)や活性酸素産生の能力が著しく低下しており、DOCK2こそがRacを活性化する分子だということがわかった」と福井教授。さらに今回、DOCK2に緑色蛍光タンパク質(GFP)を結合させることで、好中球内でのDOCK2の局在を可視化したところ、DOCK2を細胞膜に引き寄せるためにはPIP3が重要ではあるものの、それだけでは不十分であることを突き止めた。「DOCK2が集まって仮足を作るには、『ホスファチジン酸(PA)』という別のリン脂質も必要であることがわかった」と福井教授。
やや込み入ったメカニズムだが、まとめると以下のような流れになる。1.好中球の細胞膜にある受容体が、病原体由来のペプチドなどと結合する。 2. PIP3が作られる 3. DOCK2が細胞膜に引き寄せられる 4. PAが作られる 5.PAとの相互作用で DOCK2が特定部位に集まる 6. Racのスイッチがオンになり、DOCK2の局在部位でアクチン繊維が再構成される 7. 仮足を伸ばして移動を始める 8.並行して活性酸素が作られる 9.病原体をどん食し、駆逐する
免疫応答は生体防御に必須だが、過剰な免疫応答は自己免疫疾患やアレルギー疾患を引き起こす。「DOCK2の機能を制御することで、これらの疾患をコントロールしたり、臓器移植の際の拒絶反応を抑えることなどが可能かもしれない」。そう話す福井教授は、モデル動物の実験によって、DOCK2を欠損させると自己免疫疾患の発症を完全に抑制できること、移植した心臓の長期生着が可能になることなどを確かめており、新たな創薬研究に結びつく可能性も出てきた。すでに福井教授は、自らの手でDOCK2阻害剤の研究開発を始めているほか、DOCK2やその関連分子をさらに詳細に検討し、細胞骨格の再構成に至るシグナル伝達機構の全貌を明らかにしたいとしている。「基礎研究が多くの患者さんを救うポテンシャルを秘めていることを実証したい」と福井教授。基礎から応用まで、DOCK2をめぐる熱い研究が続く。
西村尚子
サイエンスライター